国家药品监督管理局药品评价中心(NMPA CDR)为了落实NMPA 2018年10号公告“自2019年7月1日起,报告上市后药品不良反应可适用M1和E2B(R3)”的要求,2019年5月17日开始进行网关联调测试。
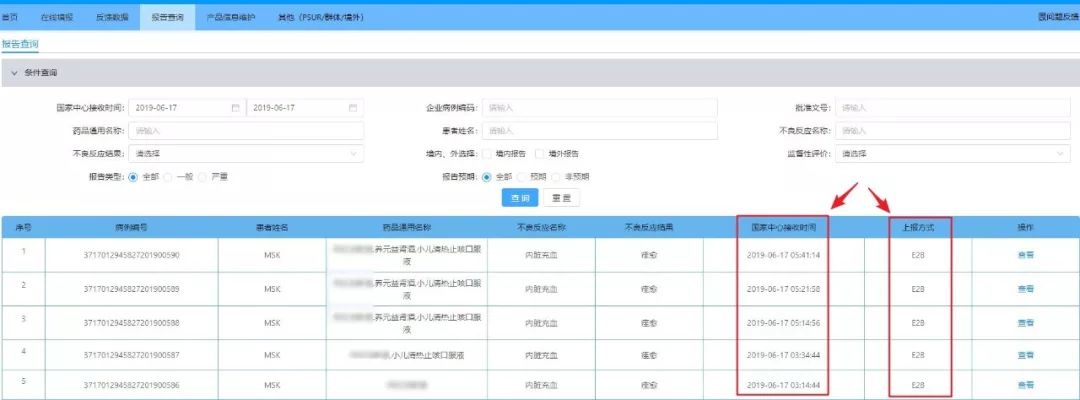
百奥知作为国内领先的药物警戒系统供应商,积极参与第一轮测试,并于2019年6月25日率先提交了测试报告及针对直报系统网关的优化建议。
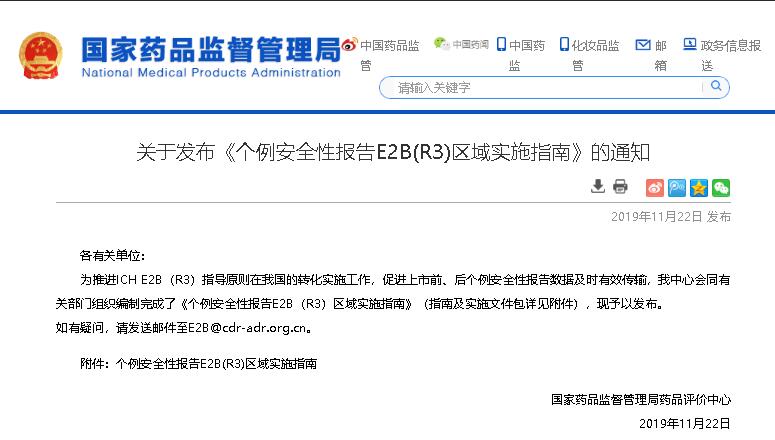
2019年11月22日,NMPA CDR发布《个例安全性报告E2B(R3)区域实施指南》。
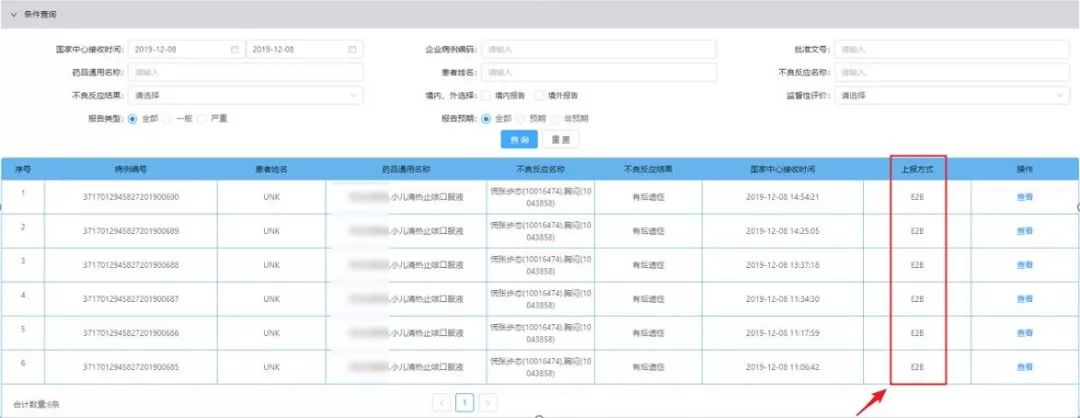
在此之前百奥知已经开始了上市后E2B R3网关传输第二次联调测试,并顺利通过联调测试(包括首次递交、随访递交、文献/附件递交、异常测试、数据校验测试等内容),最终于2019年12月14日将第二轮网关传输测试报告及优化建议提交至NMPA CDR。
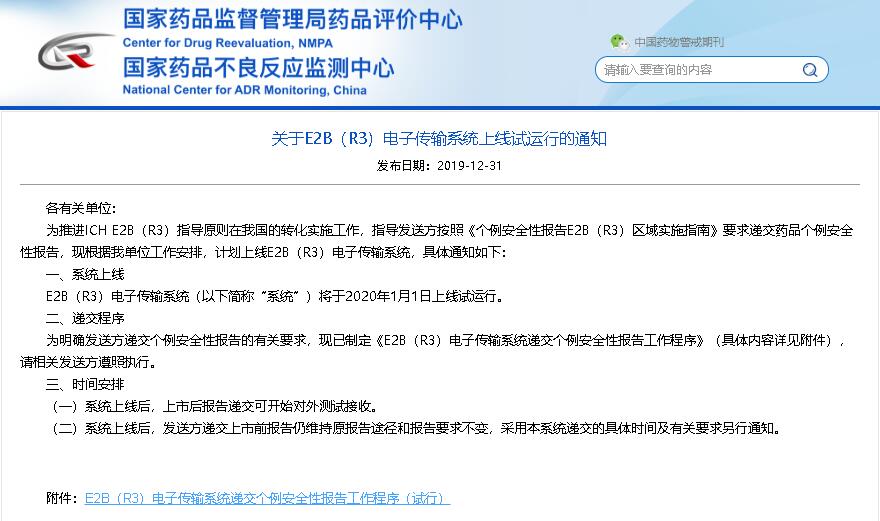
2020年1月1日,直报系统(DAERS)的E2B R3 Gateway递交功能将正式上线,届时,百奥知药物警戒系统也将同步上线此功能给广大客户。
至此,百奥知药物警戒系统目前已完成E2B Gateway对接国家药品监督管理局药品评价中心(NMPA CDR)、国家药品监督管理局药品审评中心(NMPA CDE)、美国食品药品监督管理局(FDA)和欧洲药品管理局(EMA)等药监部门,并已成功为客户实施中美双报英文药物警戒系统。
未来,我们将继续紧跟国际国内监管步伐,持续加大产品开发能力和创新力度,为广大客户提供覆盖药品全生命周期的综合解决方案,满足监管需求,体现药物警戒实际价值,保障患者用药安全。