
临床试验过程中对文档的合规性,上传、归档及时性,以及文档质量提出了很高的要求,项目内人员多、流动性大,所需收集文档多、来源广,使用传统的文档管理方法难以满足文档管理过程中的合规、及时性要求,并且文档质量难以保证,项目风险无法提前预测。
Bioknow eTMF-临床试验全文档管理系统遵循GCP、NMPA 行业有关药物、器械、疫苗等临床试验质量管理的标准规范,符合FDA 21 CFR Part 11的要求,满足DIA文档管理的最新标准,在合规的基础上为用户提供便捷且流畅的交互体验,在提高效率的同时又可保证文档质量。通过丰富的多维度报表帮助用户及时洞察项目风险,保证项目进度和质量。
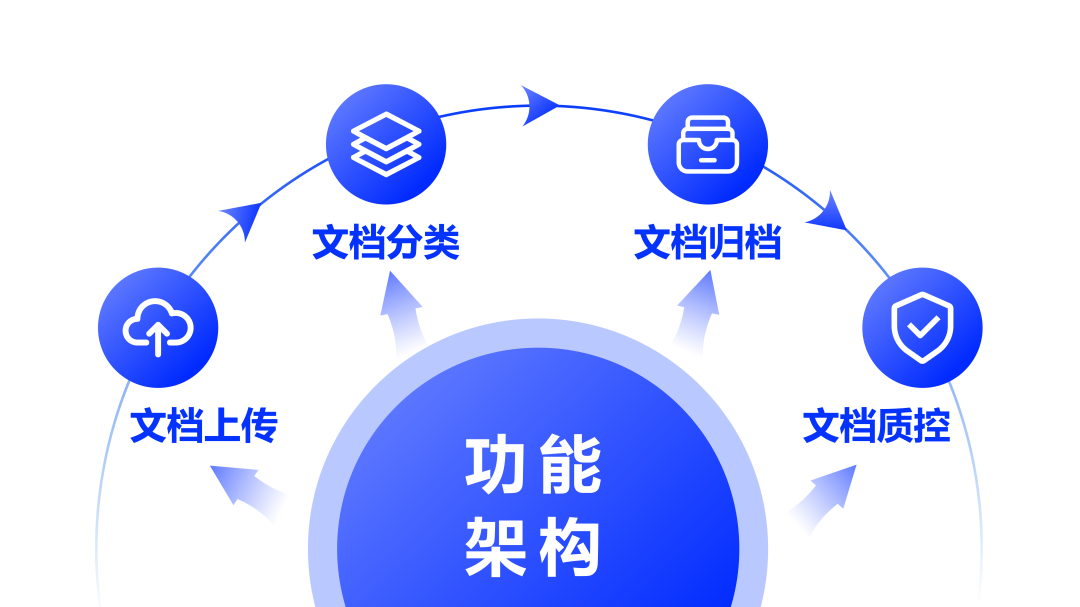
功能架构
产品优势
核心功能
系统灵活、可配置
① 系统内置DIA 3.0目录模板,并可根据客户实际业务需求做更改
② 可依据企业内部sop自定义文档的审批流程
③ 角色和权限也可根据实际需要做定制
④ 按需自由批量创建占位符
在满足规范化管理的同时,又能够便捷地处理文档任务,减少配置时间,提升配置效率
高效收集和归档
① 系统提供多种上传和分类方式,保证上传的及时性和分类的准确性
② 多种批量操作快捷处理审批任务,提高审批效率
③ 版本对比、在线批注,帮助文档快速归档
全面的文档质控
QC人员可在线质控,且质控过程稽查轨迹完整,既合规又能提升质量
典型客户
Bioknow eTMF系统为国内TOP20的创新药企和世界TOP20的CRO公司中的众多企业提供服务,使用场景覆盖全面,充分满足客户实际业务需求。
某CRO客户的实际困境
项目众多,团队管理难,SOP落地难,人员流动性大;文件缺失风险高,统计困难,分析耗费大量精力,质量无法及时准确的把握,项目风险难预测。